OKSIDACINĖS-REDUKCINĖS SISTEMOS SVARBA REGULIUOJANT NAVIKINIŲ LĄSTELIŲ PRISITAIKYMĄ IŠVENGTI TERAPINIŲ PRIEMONIŲ POVEIKIO IR NAUJOS TERAPINIO POVEIKIO JAI GALIMYBĖS
Pagal Trachootham D, Alexandre J, Huang P. Targeting cancer cells by ROS-mediated mechanisms: a radical therapeutic
approach? Nature Reviews Drug Discovery 2009;8:579–591.
ĮVADAS
Tobulinant vaistus nuo vėžio siekiama didinti jų veiksmingumą ir poveikio specifiškumą. Nustačius tam tikrus genetinius skirtumus tarp navikinių ir sveikų audinių ląstelių ir juos išstudijavus, buvo sukurta nauja specifi nio gydymo kryptis – taikinių terapija; šios grupės vaistai, pavyzdžiui, imatinibas ar trastuzumabas, pasižymi dideliu gydomuoju veiksmingumu ir sukelia palyginti nedaug nepageidaujamų reiškinių. Vis dėlto naudojant šiuolaikinį į ląstelės genomą nukreiptą gydymą vis dar susiduriama su sunkumais, atsirandančiais dėl besiformuojančio atsparumo vaistams ar dėl navikinių ląstelių genominio nestabilumo. Be to, navikinėse ląstelėse dažnai nustatomi ne pavieniai, o dauginiai genetiniai pakitimai, todėl, norint veiksmingai sunaikinti šias ląsteles, kartais prireikia naudoti į skirtingus taikinius nukreiptų vaistų derinius. Naujausių tyrimų duomenys iškelia prielaidas, kad taikymasis į išskirtinius tik navikinėms ląstelėms būdingus biocheminius sutrikimus leistų padidinti gydymo veiksmingumą ir specifiškumą bei išvengti atsparumo vaistams. Daugumai navikinių ląstelių būdinga sustiprėjusi aerobinė glikolizė (Warburgo efektas) ir suintensyvėjęs oksidacinis stresas – šie reiškiniai galėtų būti labai svarbūs kuriant naujus vėžio gydymo būdus.
Daugėja įrodymų, kad daugumai navikinių ląstelių būdingas padidėjęs reaktyviųjų deguonies radikalų (angl. Reactive oxygen species – ROS) kiekis, palyginti su sveikų audinių ląstelėmis. ROS – tai aktyvūs cheminiai junginiai, turintys deguonies. Jie skirstomi į dvi grupes:
1) laisvieji radikalai – išorinėse molekulių orbitose turintys vieną ar daugiau nesuporuotų elektronų (pavyzdžiui, superoksidas, nitroksidas, hidroksilo radikalas);
2) chemiškai aktyvūs junginiai, galintys transformuotis į laisvuosius radikalus (pavyzdžiui, vandenilio peroksidas, ozonas, peroksinitratas, hidroksidas). ROS yra būtini ląstelės gyvybinėms funkcijoms: jie reguliuoja daugumą signalo perdavimo kelių, tiesiogiai reaguodami su baltymų, transkripcijos veiksnių ir tam tikrų genų struktūromis, taip moduliuodami jų funkcijas; dalyvauja perduodant signalus, skatinančius ląstelių augimą bei dalijimąsi; reguliuoja fermentų, sukeliančių uždegimo reakcijas, aktyvumą, padėdami sunaikinti patogenus ir svetimas organizmui daleles. Tačiau ROS turi ir neigiamų savybių. Laisvieji deguonies radikalai labai aktyviai reaguoja su dauguma molekulių, tarp jų ir DNR, baltymais bei lipidais.
Nežymus ROS kiekio padidėjimas gali sukelti tik laikinus ląstelių pažeidimus, tačiau stiprus ROS kiekio padidėjimas sukelia negrįžtamus oksidacinius pakitimus ir ląstelės žūtį. ROS gali būti gaunami iš išorės, pavyzdžiui, susidarę dėl aplinkos taršos, rūkymo, metalų druskų ar išorinės jonizuojamosios radiacijos poveikio, taip pat ROS gaminami ir organizmo ląstelėse.
Pagrindinis ROS gamybos šaltinis ląstelėse – mitochondrijos. Taigi, ROS homeostazės palaikymas yra būtinas normaliam ląstelės augimui. 1 paveiksle vaizduojama, kokiais būdais palaikoma pusiausvyra tarp ROS gamybos ir eliminavimo. ROS kiekio padidėjimas susijęs su nenormaliu vėžinių ląstelių augimu ir atspindi oksidacinės-redukcinės sistemos sutrikimus – ROS gamybos padidėjimą arba pablogėjusį ROS šalinimą; ši ląstelės būsena vadinama oksidaciniu stresu.
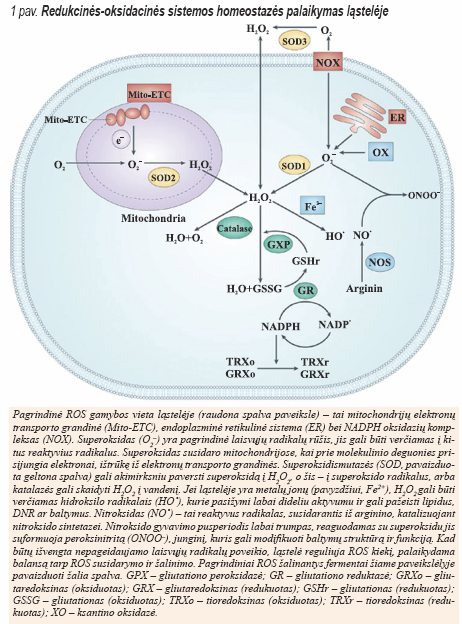
Kadangi ROS kiekio padidėjimas ląstelėse svarbus inicijuojant kancerogenezę ir jai vystantis, šis vidinis oksidacinis stresas dažnai įvardijamas kaip nepageidaujamas reiškinys. Šiaip ar taip, per didelis ROS kiekis ląstelėms kenkia; manoma, kad navikinės ląstelės, esant padidėjusiam vidiniam oksidaciniam stresui, turėtų būti daug jautresnės išorinių veiksnių lemto ROS kiekio padidėjimo poveikiui. Taigi, ROS kiekio keitimas moduliuojant ląstelės oksidacinę- redukcinę sistemą būtų perspektyvus būdas, siekiant sunaikinti navikines ląsteles, nesukeliant stipresnio sveikų ląstelių pažeidimo. Kitas svarbus reiškinys yra tai, kad ląstelės, išgyvenusios padidėjusį vidinį oksidacinį stresą, prie jo prisitaiko, įgydamos didesnį endogeninės antioksidacinės sistemos pajėgumą; taip ląstelė gali išgyventi ir padidėjus egzogeniniam oksidaciniam stresui. Šios ląstelės gali mobilizuoti savo adaptacinius mechanizmus, kurie ne tik aktyvina antioksidacinę ląstelės sistemą, bet ir slopina apoptozę. Tokia adaptacija gali būti susijusi su ląstelių piktybine transformacija, metastazavimu ir atsparumu vaistams nuo vėžio. Norint veiksmingai sunaikinti navikines ląsteles ir įveikti atsparumą vaistams nuo vėžio, susijusį su oksidacinės-redukcinės sistemos adaptacija, būtina tiksliai išsiaiškinti sudėtingus šios sistemos pakitimus ir juos lemiančius mechanizmus navikinėse ląstelėse.
OKSIDACINIO STRESO NAVIKINĖSE LĄSTELĖSE REIKŠMĖ IR MECHANIZMAI
Palyginti su normaliomis ląstelėmis, navikinės ląstelės funkcionuoja oksidacinio streso sąlygomis tiek in vivo, tiek in vitro. Pvyzdžiui, leukeminėse ląstelėse, paimtose iš pacientų, sergančių lėtine limfocitine leukemija ar plaukuotųjų ląstelių leukemija, užfiksuota padidėjusi ROS gamyba, palyginti su normaliais leukocitais. Taip pat piktybinėse ląstelėse nustatytas labai pakitęs ROS šalinančių fermentų – SOD, gliutationo peroksidazės, peroksiredoksino – kiekis; manoma, kad piktybinėse ląstelėse sutrikusi oksidacinė-redukcinė sistema ir pakitusi adaptacija oksidaciniam stresui. Nors veiksniai, sukeliantys padidėjusį oksidacinį stresą navikinėse ląstelėse, nėra tiksliai žinomi, yra nustatyta keli vidiniai ir išoriniai mechanizmai. Onkogenų aktyvinimas, sutrikęs metabolizmas, mitochondrijų disfunkcija, funkcionalaus p53 praradimas – tai vidiniai ląstelės veiksniai, sukeliantys padidėjusią ROS gamybą navikinėse ląstelėse. Esant pažengusių stadijų navikams, navikinės ląstelės paprastai būna genetiškai nestabilios, dėl to gamina daugiau ROS, susidaro vadinamasis ydingas ratas – ROS lemia genų mutacijas (ypač mitochondrijų genomo), o sutrikus jų funkcijai gaminama daugiau ROS (2 pav.).
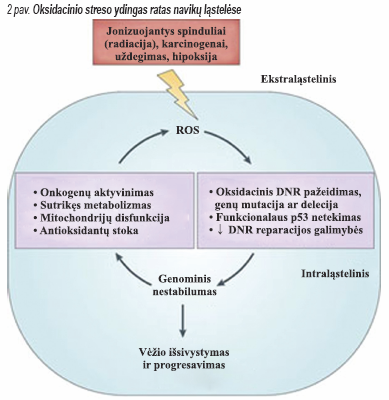
Be vidinių intraląstelinių veiksnių, oksidacinę-redukcinę sistemą gali veikti ir išoriniai veiksniai, pavyzdžiui, uždegimo citokinai, tam tikros maiste esančios medžiagos ar hipoksinė aplinka. Kai kuriose pirminėse navikinėse ląstelėse ROS kiekio padidėjimas ar oksiduotos DNR susidarymas susiję su antioksidantų, pavyzdžiui, SOD ar katalazės, kiekio sumažėjimu. Tačiau vis dar neaišku, ar antioksidantų stoka yra pagrindinė priežastis, dėl kurios navikinėse ląstelėse sustiprėja oksidacinis stresas. Tiriant navikinius audinius nustatytas padidėjęs kai kurių ROS šalinančių fermentų aktyvumas ir antioksidacinių molekulių kiekis; manoma, kad taip yra dėl adaptacinės reakcijos į vidinį oksidacinį stresą. Šie iš pažiūros vienas kitam prieštaraujantys duomenys tik parodo, koks sudėtingas yra oksidacinės-redukcinės sistemos reguliavimas navikinėse ląstelėse.
Sustiprėjęs oksidacinis stresas navikinėse ląstelėse susijęs su navikų piktybiškumu ir blogesne prognoze. Tyrimais įrodyta, kad oksidacinio streso sustiprėjimas labai reikšmingas atsirasti navikiniams požymiams: ląstelių nemirtingumui ir transformacijai, ląstelių proliferacijos ir mitogenezės suaktyvėjimui, ląstelės išgyvenamumui ir nereagavimui į apoptozės signalus, metastazavimui, angiogenezei bei atsparumui vaistams nuo vėžio. Tačiau kartais ROS gali lemti ir atvirkštinį poveikį, pavyzdžiui, veikdami ląstelės ciklo inhibitoriaus p16 aktyvumą, slopina naviko augimą. Be to, jei ląstelėje viršijamas tam tikras ROS slenkstinis kiekis, ROS sukelia citotoksinį poveikį – navikinių ląstelių žūtį – ir taip stabdo navikų progresavimą.
NAVIKINIŲ LĄSTELIŲ ADAPTACIJA PADIDĖJUSIAM OKSIDACINIAM STRESUI
Normalias ląsteles veikiant nedidelėmis, bet pastoviomis egzogeninių laisvųjų deguonies radikalų dozėmis, sukeliamas pripratimas netgi prie pakankamai didelio oksidacinio streso. Šie stebėjimai leido iškelti hipotezę, kad ląstelės gali adaptuotis ir išgyventi, esant tam tikram laisvųjų radikalų kiekiui. Kadangi navikinės ląstelės yra nuolat veikiamos endogeniniais laisvaisiais radikalais, tikėtina, kad natūralios atrankos būdų formuojasi ląstelių populiacijos, prisitaikiusios prie padidėjusio oksidacinio streso. Ląstelės, kurios išgyvena oksidacinį stresą, įgyja adaptacinius mechanizmus ir geba kovoti su potencialiu toksiniu laisvųjų radikalų poveikiu bei skatina formuotis naujus ląstelės išgyvenamumo mechanizmus. Pavyzdžiui, onkogeninės H-Ras transformuotos ląstelės, kuriose užfi ksuotas padidėjęs superoksido ir vandenilio peroksido kiekis, lygiai taip pat gamina daugiau antioksidantų, kaip antai peroksiredoksinas- 3 ir tioreduksino peroksidazė, palyginti su jų ne navikiniais pirmtakais. Jų padidėjusios antioksidacinės savybės padeda išvengti ROS sukeltos apoptozės; pavyzdžiui, Ras transformuotose ląstelėse nustatomas atsparumas ląstelių žūtį sukeliančiam vandenilio peroksido poveikiui.
Taip pat nustatyta, kad Ras transformuotos ląstelės daug jautriau reaguoja į gliutationo (GSH) kiekio sumažėjimą. Sumažėjus gliutationo koncentracijai, ląstelėse kaupiasi ROS, ir jos žūva. Taigi, ontioksidantai ypač reikšmingi ląstelės išgyvenamumui. Manoma, kad, vykstant piktybinei transformacijai, didėjantis ROS kiekis skatina ląstelių proliferaciją ir stimuliuoja antioksidacinius adaptacinius mechanizmus šių laisvųjų radikalų poveikiui sumažinti. Navikinėse ląstelėse oksidacinės- redukcinės sistemos homeostazė išlaikoma tik tada, kai didėjant ROS kiekiui ląstelėse didėja ROS šalinančių fermentų aktyvumas (3 pav.). Šį adaptacinį mechanizmą veikiantys veiksniai būtų puikus substratas naujų navikų terapijos priemonėms kurti.
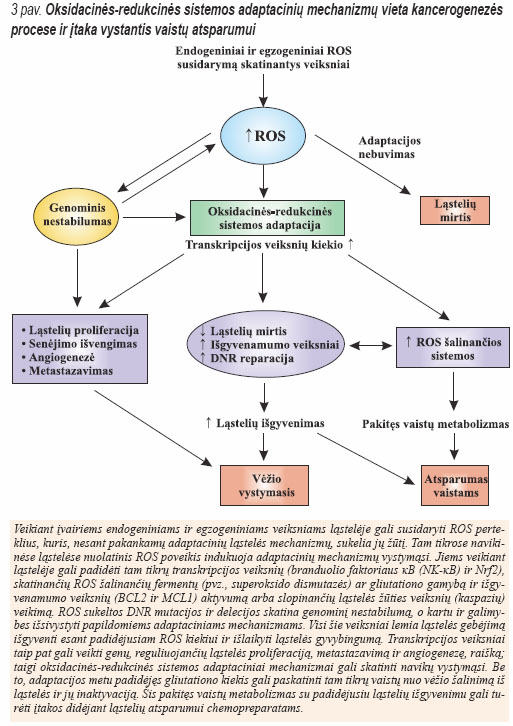
NAVIKINIŲ LĄSTELIŲ OKSIDACINĖSREDUKCINĖS SISTEMOS SUTRIKIMAI – GALIMAS TAIKINYS PLEČIANT SPECIFINIO GYDYMO GALIMYBES
Terapinis specifiškumas yra vienas pagrindinių reikalavimų gydant vėžį. Navikinėse ląstelėse pastebima padidėjusi laisvųjų radikalų gamyba, taip pat ląstelės veikiamos stipresnio oksidacinio streso, be to, jų išgyvenimas labai priklauso nuo antioksidacinės sistemos ląstelėje galimybių. Todėl jos bus jautresnės ir papildomam laisvųjų radikalų
poveikiui, ir junginiams, slopinantiems ląstelės antioksidacinę sistemą. Egzogeniniai veiksniai, didinantys ROS gamybą ir slopinantys antioksidacinę sistemą, galėtų išbalansuoti oksidacinę-redukcinę ląstelės sistemą ir taip didinti bendrą ROS kiekį – slenkstinės dozės viršijimas sukeltų ląstelės žūtį.
ROS gamybos skatinimas
Elektronai, ištrūkę iš mitochondrijų kvėpavimo grandinės, yra pagrindinis ROS gamybos šaltinis. Nustatyta, kad junginiai, trikdantys kvėpavimo grandinės veikimą, pavyzdžiui, arseno trioksidas, didina superoksido gamybą. Kiti junginiai veikia reaguodami su fl avoproteinų reduktazėmis, dalyvaujant redukuotam NADPH. Sukuriami tarpiniai reaktyvūs
junginiai, kurie, jei aplinkoje yra molekulinio deguonies, virsta superoksidu. Šių preparatų pavyzdžiai galėtų būti moteksafino gadolinis arba antraciklinai (daunorubicinas ir doksorubicinas).
Kai kurie junginiai pasižymi potencialiu gebėjimu skatinti ROS gamybą tiek in vivo, tiek in vitro, nors tikslus jų veikimo mechanizmas kol kas nėra aiškus. Elesklomolis (STA-4783) – tai naujas junginys, kurio veiksmingumas gydant melanomą nustatytas II klinikinės fazės tyrimu (pailgėjo išgyvenamumas be ligos progresavimo); manoma, kad pagrindinis antinavikinis jo veikimas – tai ROS kiekio didinimas ir oksidacinis poveikis navikinėms ląstelėms. Buvo pastebėta, kad laisvųjų radikalų neutralizavimas antioksidantais susilpnino šio preparato poveikį. Deja, III fazės klinikiniai tyrimai su elesklomoliu dėl per didelio pastarojo toksiškumo buvo sustabdyti. Priežastys, dėl kurių pacientams, sirgusiems IV stadijos melanoma ir gydytiems paklitakselio ir elesklomolio deriniu, buvo užfi ksuotas padidėjęs mirštamumas, vis dar neišaiškintos.
Norint toliau tęsti klinikinius tyrimus su šiuo preparatu, būtina išsiaiškinti tikslius vaisto veikimo bei toksiškumo mechanizmus.
Poveikis ROS metabolizmui
Gliutationas yra pagrindinis veiksnys, atliekantis laisvųjų radikalų šalinimo funkciją ląstelėse. Fermentai, reguliuojantys oksidacinę-redukcinę sistemą, priklauso nuo redukuoto gliutationo sankaupų, jis yra pagrindinis redukcinio potencialo šaltinis. Taigi, bandymai sumažinti redukuoto gliutationo kiekį būtų veiksmingi mažinant ląstelės gebėjimą detoksikuoti ROS bei kovoti su oksidaciniu pažeidimu. Tam tikri junginiai, pavyzdžiui, izotiocianatai (benzilo izotiocianatas (BITC), fenetilo izotiocianatas (PEITC) ir sulforafanas) bei aziridino junginiai (imeksonas) akimirksniu jungiasi su gliutationu, taip išeikvodami gliutationo atsargas ir dėl oksidacinio streso sukeldami ląstelės žūtį. Mažinti gliutationo kiekį galima ir veikiant jo sintezę. Butionino sulfoksiminas (BSO) yra gliutationo sintetazės inhibitorius (γ-GCS) – užfiksuotas jo antinavikinis veiksmingumas. Sulfasalazinas, slopindamas cistino (cisteino pirmtako, kuris yra gliutationo sintezės substratas) pasisavinimą, taip pat mažina gliutationo kiekį.
Dar viena labai svarbi tiolų pagrindu veikianti antioksidacinė sistema – tai tioredoksinas. Nustatyta, kad navikinėse ląstelėse yra sutrikęs jo veikimas, o tai susiję su naviko piktybiškumu ir atsparumu vaistams. Pastaruoju metu kuriami specifiniai inhibitoriai, kurie veikia tioredoksiną 1 (Trx-1) ir tioredoksino reduktazę (TR1). Taip pat kuriami preparatai, specifi škai veikiantys tokius antioksidacinius fermentus kaip superoksidismutazė, katalazė ir hemoksigenazė 1 (HMOX1). Pagrindinių oksidacinę- redukcinę ląstelės sistemą veikiančių preparatų veikimo mechanizmai apibendrinti 1 lentelėje.
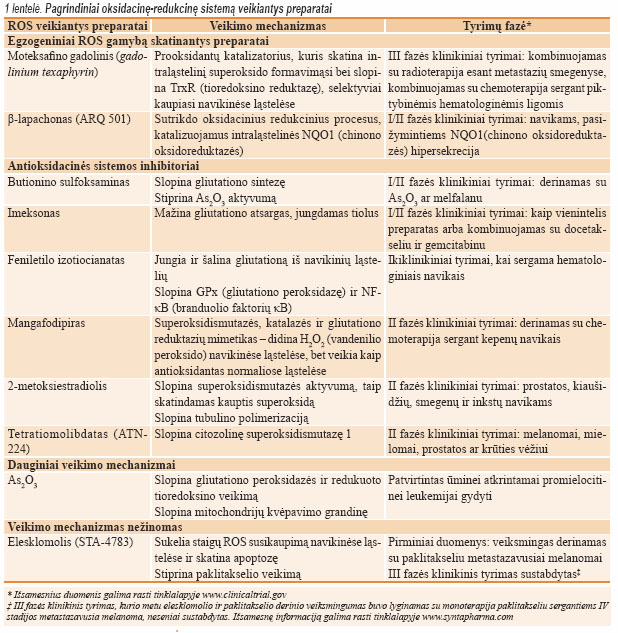
Atsparumo vaistams, susijusio su oksidacinės-redukcinės sistemos adaptacija, įveikimas
Žinoma, kad kai kurios navikinės ląstelės, ypač esant pažengusioms vėžio stadijoms, labai prisitaikiusios prie vidinio oksidacinio streso poveikio. Ši oksidacinės- redukcinės sistemos adaptacija ne tik leidžia navikinėms ląstelėms išgyventi esant padidėjusiam oksidaciniam stresui, bet ir suteikia galimybę ištverti daugelio antinavikinių preparatų poveikį, nes kartu didėja atsparumas išoriniams oksidaciniams veiksniams ir ląstelių gebėjimas neutralizuoti vaistus, daugėja vidinių ląstelės išgyvenamumo veiksnių. Pavyzdžiui, nustatyta, kad daugeliui vaistų atsparios HL-60 leukeminės ląstelės taip pat atsparios citotoksiniam H2O2 poveikiui; ši savybė atsiranda dėl padidėjusio katalazės kiekio ir aktyvumo. Atsparumas arseno trioksidui, manoma, susijęs su padidėjusia HMOX1, SOD1 ir gliutationo koncentracija. Kelių tyrimų duomenimis, atsparumas vaistams, kurie didina intraląstelinę ROS gamybą, pavyzdžiui, paklitakselis, doksorubicinas ar platinos junginiai, susiję su antioksidacinės sistemos aktyvėjimu.
Norint pagerinti terapinį specifi škumą ir įveikti atsparumą vaistams, susijusį su oksidacinės redukcinės sistemos adaptacija, labai svarbu sukurti metodus, kuriais būtų galima nustatyti oksidacinių- redukcinių mechanizmų skirtumus tarp normalių ir navikinių ląstelių; galbūt tai leistų įveikti adaptaciją oksidaciniam stresui navikinėse ląstelėse. Taip pat svarbu, kad toms ląstelėms, kurios, didindamos antioksidacinės sistemos (dažniausiai dėl suaktyvėjusio gliutationo veikimo) galimybes, prisitaikė prie oksidacinio streso poveikio, bus visiškai neveiksmingi preparatai, kurių veikimo principas paremtas tik ROS kiekio didinimu. Geriausia strategija būtų naudoti junginius, kurie veikia adaptacinius mechanizmus.
Vaistų, veikiančių oksidacinę-redukcinę sistemą, derinimo strategijos
Norint kuo geriau išnaudoti ROS sukeliamą poveikį, būtų tikslinga derinti preparatus, kurie ne tik skatintų ROS gamybą, bet ir slopintų ląstelės antioksidacines galimybes. Šis metodas būtų ypač veiksmingas kovojant su navikinėmis ląstelėmis, įgavusiomis atsparumą oksidaciniam stresui bei vaistams nuo vėžio. Pavyzdžiui, derinant ROS gamybą
skatinantį arseno trioksidą su SOD inhibitoriumi 2-ME, buvo užfi ksuotas citotoksinis poveikis lėtinės limfoleukemijos ląstelėms, kurios buvo atsparios vien 2-ME poveikiui. Paskutiniais tyrimais nustatyta, kad transkripcijos faktorius Nrf2 lemia atsparumą gliutationą slopinančio preparato BSO poveikiui, o šio transkripcijos faktoriaus blokavimas bei derinimas su BSO yra veiksminga terapinė priemonė. Remiantis eksperimentiniais tyrimais, šiuo metu kliniškai tiriamas kai kurių oksidacinę-redukcinę sistemą veikiančių preparatų veiksmingumas (1 lentelė).
Kadangi spindulinis gydymas ir kiti įprastiniai antinavikiniai chemopreparatai tiesioginiu ar netiesioginiu būdu taip pat gali didinti ROS kiekį navikinėse ląstelėse, šių gydymo metodų derinimas su preparatais, besitaikančiais į ląstelės oksidacinę- redukcinę sistemą, galėtų būti perspektyvi gydymo strategija.
REDUKCINĖ OKSIDACINĖ SISTEMA NAVIKŲ KAMIENINĖSE LĄSTELĖSE
Navikinės ląstelės po chemoterapijos ir radioterapijos dažniausiai atsinaujina dėl išlikusių piktybinių ląstelių, ypač atsparių gydymui, subpopuliacijos. Manoma, kad šios ląstelės – tai navikų pirmtakai, kitaip tariant, kamieninės ląstelės. Buvo pastebėta, kad nedidelė pirminių ląstelių subpopuliacija, ekspresuojanti kamieninių ląstelių žymenis, buvo atspari tam tikriems chemopreparatams bei jonizuojantiems spinduliams. Paskutinių klinikinių tyrimų duomenimis, nustatyta, kad normalios kamieninės hemopoetinės sistemos ląstelės geba išlaikyt mažesnį ROS kiekį, palyginti su subrendusiomis ląstelėmis, – kad išvengtų ląstelių diferenciacijos ir ilgai išsaugotų gebėjimą atsinaujinti. Taip pat nustatyta, kad ir navikinių ląstelių pirmtakuose, kaip ir normaliose kamieninėse ląstelėse, būna sumažėjęs ROS kiekis, palyginti su paprastomis subrendusiomis nenavikinėmis ląstelėmis. Toks nedidelis ROS kiekis gali būti susijęs su padidėjusia ROS šalinančių fermentų raiška, lemiančia atsparumą jonizuojantiems
spinduliams (radioterapijai). Tik nustačius tikslius molekulinius mechanizmus, kuriais navikinės kamieninės ląstelės palaiko oksidacinės-redukcinės sistemos homeostazę, būtų galima ieškoti būdų, kaip anuliuoti šių kamieninių ląstelių išgyvenamumo veiksnius ir taip sunaikinti patį navikų pagrindą. Taip pat gal bus galima atsakyti į iškylančius klausimus. Ar antioksidacinės sistemos slopinimas kamieninėse navikų ląstelėse įjautrintų jas kitiems antivėžiniams preparatams? Ar egzogeninis oksidacinis stresas gali sukelti kamieninių požymių praradimą šiose ląstelėse? Ar oksidacinės-redukcinės sistemos moduliatorių derinimas su standartiniu antivėžiniu gydymu būtų efektyvesnė strategija naikinant kamienines navikines ląsteles nei vien įprastas gydymas?
Svarbu, kad kai kurios kamieninės ląstelės gyvuoja palyginti mažai deguonies turinčioje aplinkoje. Šios hipoksinės nišos turi įtakos ribojant ląstelių diferenciaciją bei išlaikant jų kamienines savybes. Be to, deguonies stoka stabdo endogeninių ROS gamybą. Kadangi kamieninės navikų ląstelės dažnai egzistuoja hipoksinėje aplinkoje, jos bus ne gydymui, nes veiksmingam šių priemonių veikimui dažniausiai reikalingas deguonis. Taigi, reikia gerai pasvarstyti, kaip galima panaudoti gydymo strategijas, kad jos veiktų ypatingos oksidacinės- redukcinės sistemos būsenos kamienines navikines ląsteles, esančias hipoksinėje aplinkoje.
APIBENDRINIMAS
Navikinėse ląstelėse užfiksuotas padidėjęs ROS kiekis, kuris skatina ląstelių proliferaciją ir daugeliu atvejų yra susijęs su oksidacinės-redukcinės sistemos adaptacija, dėl kurios didėja ląstelių gebėjimas išgyventi bei atsparumas vaistams. Taikymasis į šiuos biocheminius navikinių ląstelių rodiklius yra perspektyvus būdas, siekiant padidinti terapinį specifiškumą ir nugalėti besivystantį atsparumą vaistams.
Oksidacinio streso vaidmuo kancerogenezėje leidžia kalbėti apie dvi visai skirtingas navikų gydymo strategijas.
Viena iš jų būtų didinti antioksidacinius ląstelių išteklius, skiriant antioksidantus, tikintis, kad taip bus sustabdytas nuo ROS priklausomas navikų proliferaciją stimuliuojantis poveikis. Paradoksalu, tačiau keli antioksidantai, tirti klinikiniais tyrimais, buvo susiję su padidėjusiu navikų dažniu. Šis nepageidaujamas antioksidantų poveikis galėjo būti dėl ROS indukuojamos apoptozės ir oksidaciniostreso sukelto žalingo poveikio slopinimo ir pagelbėti navikinėms ląstelėms išgyventi. Be to, šių eksperimentų rezultatai leidžia daryti prielaidą, kad antioksidantai mažina tam tikrų vėžio gydymo metodų (pavyzdžiui, paklitakselio, bortezomibo ir radioterapijos) veiksmingumą, nes šių metodų poveikis susijęs su ROS gamyba. Priešinga gydymo strategija būtų gydyti navikus preparatais, didinančiais prooksidacines ląstelių savybes (arba didinant ROS kiekį ląstelėse, arba slopinant ląstelės antioksidacinį pajėgumą). Ikiklinikiniuose modeliuose naudojant ROS gamybą skatinančius preparatus, pastebėtas jų selektyvus toksiškumas navikinėms ląstelėms, kuriose padidėjęs oksidacinis stresas. Vaistų, didinančių ROS gamybą ir slopinančių antioksidacinę sistemą, derinys – puiki strategija, didinant antinavikinį citotoksinį poveikį. Kita vertus, ši strategija gali didinti ROS kiekį normaliose ląstelėse ir taip sukelti jų mutacijas. Oksidacinės-redukcinės sistemos adaptacija navikinėse ląstelėse būtų galima paaiškinti tai, kaip jos išgyvena esant nuolat padidėjusiam endogeniniam oksidaciniam stresui, ir tai, kaip jos tampa atsparios vaistams nuo vėžio. Metodus, kuriais būtų galima paveikti šiuos adaptacinius mechanizmus, būtų galima sėkmingai derinti su įprastiniu vėžio gydymu (chemoterapija ar radioterapija). Išnaudojant ir toliau tiriant unikalius navikų kamieninių ląstelių oksidacinėsredukcinės sistemos ypatumus, būtų galima ypač veiksmingai ir selektyviai taikyti vėžio gydymo metodus, nepakenkiant normalioms, pavyzdžiui, hemopoetinėms, kamieninėms ląstelėms.
Parengė gyd. Daiva SENDIULIENĖ

